平成28年(ネ)第10046号 特許権侵害差止請求控訴事件平成29年1月20日判決言渡「オキサリプラチン事件」
(パテントメディア2017年9月発行第110号掲載)
弁理士 中村美樹
特許権存続期間の延長後の特許権の効力の及ぶ範囲(特許法第68条の2)について判断された知財高裁の大合議判決について紹介します。
1.特許権の存続期間の延長登録出願についての背景
特許権の存続期間の延長登録出願とは、農薬・医薬品等、安全性の確保等を目的とする法律の規定による許可等を得るための試験・審査等によって特許発明を実施することのできない期間があったときに、5年を限度として、特許権の存続期間を延長することを求める出願のことをいいます。
近年、この延長登録出願に関する審査基準が、最高裁判決の内容を受けて、二度改訂されました(平成23年及び平成28年)。今回ご紹介する大合議判決の意義を説明するために、審査基準の改定の契機となった二度の最高裁判決の内容を簡単に説明します。
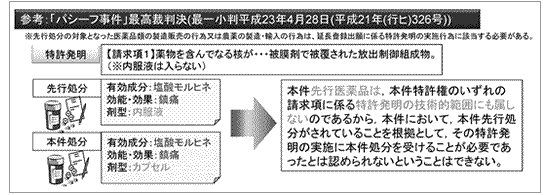
(1)平成23年4月28日 最高裁判決「パシーフカプセル事件」
特許第3134187号「放出制御組成物」
「パシーフカプセル事件」に係る最高裁判決が出された当時の審査基準(便宜上「旧旧審査基準」と称します)によれば、「延長理由処分の医薬品Xの承認の『有効成分』及び『効能・効果』が、先行処分の医薬品Aの承認の『有効成分』及び『効能・効果』と同じである延長登録出願は、67条の3第1項第1号により拒絶する」とされていました。すなわち、この旧旧審査基準は、「有効成分」・「効能・効果」の同一性を基準とする規定でした。
したがって、以下の図で示すように、たとえば、有効成分を「塩酸モルヒネ」、効能・効果を「鎮痛」とする先行処分が存在する場合、同じ有効成分及び効能・効果を有するが剤型の異なる後行処分(たとえば、先行処分は内服液に対し後行処分はカプセル剤)に基づく特許権の延長は認められませんでした。こうした状況に対し、最高裁は以下の判決を行い、その結果、審査基準が改定されました(平成23年12月28日以降。便宜上、「旧審査基準」と称します)。
[最高裁判決]
本件先行医薬品は、本件特許権のいずれの請求項に係る特許発明の技術的範囲にも属しないのであるから、本件において、本件先行処分がされていることを根拠として、その特許発明の実施に後行処分を受けることが必要であったとは認められないということはできない。
[残された課題]
「パシーフカプセル事件」の最高裁判決により、たとえば剤型、用法・用量等の異なる後行処分に基づく特許権の存続期間の延長登録が認められ得るようになりました。しかしながら、この判決後にも残された課題として、以下の2点がありました。
課題1:
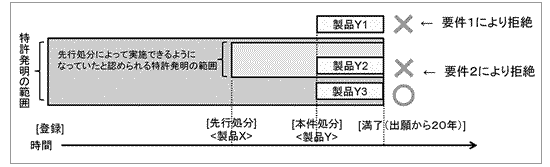
課題1は、「先行処分に係る先行医薬品が対象特許の技術的範囲に属する場合はどうするのか。」というものです。すなわち、「パシーフカプセル事件」の後に改訂された「旧審査基準」によれば、下表に示す特許発明Aのように、本件処分(後行処分)の剤型に関する限定事項を有する場合には、本件処分に基づく特許権の延長が認められます。一方、特許発明Bのように剤型に関する限定事項を有さない場合、特許権の延長が認められません。
|
先行処分
|
本件処分
|
特許発明A
|
特許発明B
|
|
|
有効成分
|
物質A
|
物質A
|
物質A
|
物質A
|
|
効能・効果
|
鎮痛
|
鎮痛
|
鎮痛
|
鎮痛
|
|
剤型
|
錠剤
|
カプセル剤
|
カプセル剤
|
限定無し
|
|
延長
|
|
|
○
|
×
|
| ↑ 問題あり |
[旧審査基準の概要]
要件①本件処分の対象となった医薬品類の製造販売の行為が、延長登録の出願に係る特許発明の実施行為に該当すること
要件②本件処分の対象となった医薬品類の「発明特定事項(及び用途)に該当する事項」によって特定される範囲において、本件処分が最初の処分であること
課題2:
課題2は、「特許権の効力の及ぶ範囲(特許法第68条の2)をどのように解するべきか。」というものです。特許法第68条の2(存続期間が延長された場合の特許権の効力)には、「特許権の存続期間が延長された場合・・・の当該特許権の効力は、その延長登録の理由となつた第六十七条第二項の政令で定める処分の対象となつた物(その処分においてその物の使用される特定の用途が定められている場合にあつては、当該用途に使用されるその物)についての当該特許発明の実施以外の行為には、及ばない」と規定されています(下線は筆者による)。
しかしながら、特許法第68条の2でいう「処分の対象となつた物」とはどのような範囲であると解釈されるのか(処分の対象となった物と均等の範囲は含まれるのか。同一とはどのような範囲か)ということが明確ではありませんでした。
(2)平成27年11月17日 最高裁判決「アバスチン事件」
(上記課題1を解決)
特許第3398382号「血管内皮細胞増殖因子アンタゴニスト」
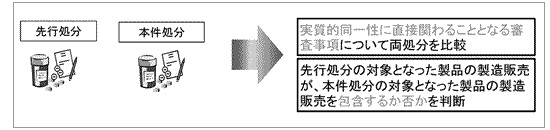
最高裁は以下の判決を行うことにより、上記の「課題1」を解決しました。すなわち、「アバスチン事件」の後に改訂された現審査基準(平成28年4月1日以降)によれば、医薬品類としての実質的同一性に直接関わることとなる審査事項について両処分を比較し、先行処分の対象となった医薬品類の製造販売が本件処分の対象となった医薬品類の製造販売を包含しない場合には、本件処分に基づく特許権の延長が認められるようになりました。
[最高裁判決](下線は筆者による)
出願理由処分と先行処分がされている場合、延長登録出願に係る特許発明の種類や対象に照らして、医薬品としての実質的同一性に直接関わることとなる審査事項について両処分を比較した結果、先行処分の対象となった医薬品の製造販売が、出願理由処分の対象となった医薬品の製造販売を包含すると認められるときは、延長登録出願に係る特許発明の実施に出願理由処分を受けることが必要であったとは認められない。
医薬品としての実質的同一性に直接関わることになる両処分の審査事項は、医薬品の成分、分量、用法、用量、効能及び効果である。
2.本事案(平成28年(ネ)第10046号 特許権侵害差止請求控訴事件)の解説
(1)経緯及び概要
本事案において、知財高裁の大合議は、上述した「課題2」について解決し得る判断を示しました。本事案の経緯は以下のとおりです。
控訴人:デビオファーム・インターナショナル・エス・アー(特許権者、先発医薬品)
被控訴人:東和薬品株式会社(後発医薬品)
特許番号:特許第3547755号「オキサリプラティヌムの医薬的に安定な製剤」
| 平成7年8月7日 | 出願(PCT/IB1995/000614→ 特願平8-507159号) |
| 平成16年4月23日 | 登録(その後、延長登録) |
| 平成27年5月8日 | 原告(デビオファーム)は、被告(東和薬品)が 原告保有の本件製剤特許を侵害するとして東京地裁に提訴 |
| 平成28年3月30日 | 東京地裁が原告(デビオファーム)の請求を棄却 |
| 平成28年3月31日 | 原告(デビオファーム、控訴人)が知財高裁に控訴 |
| 平成29年1月20日 | 知財高裁(大合議)が控訴人(デビオファーム)の控訴を棄却 |
一審原告は、先発医薬品に関する医薬品製造販売承認(先行処分)を得た後、先行処分を理由として、本件特許権の存続期間の延長登録を行いました。一審被告の製品(被告製品)は、上記先発医薬品の後発医薬品です。一審原告である特許権者は、延長登録された本件発明の技術的範囲に、被告の後発医薬品が属すると主張しました。こうした訴えは、東京地裁及び知財高裁のいずれにおいても認められませんでした。
(理由1)被告製品は、先行処分の対象となった物と実質同一なものではない→延長登録された特許権の効力が及ばない(争点2)。
(理由2)被告製品は、本件発明の技術的範囲に属さない(争点1)。
(2)本件発明について
本件発明の請求項1を分節して示すと、以下のとおりです。
A 濃度が1ないし5mg/mlで
B pHが4.5ないし6の
C オキサリプラティヌムの水溶液からなり,
D 医薬的に許容される期間の貯蔵後,製剤中のオキサリプラティヌム含量が当初含量の少なくとも95%であり,
E 該水溶液が澄明,無色,沈殿不含有のままである,
F 腸管外経路投与用の
G オキサリプラティヌムの医薬的に安定な製剤。
(3)被告(被控訴人)製品について
被告製品は、上述した一審原告(控訴人、特許権者)による先発医薬品の後発医薬品であり、被告製品の効能・効果及び用法・用量は、原告製品(エルプラット点滴静注液)と同一です(争いがない)。被告製品の組成・性状は、以下の表のとおりです。被告製品は、上記構成要件のA,B,E,Fを充足するとされており、争いはありません。被告各製品における添加物(濃グリセリン)の使用目的は、いずれも安定剤です。
|
一審被告製品
|
一審被告製品1
|
一審被告製品2
|
一審被告製品3
|
|
1バイアル容量
|
10mL
|
20mL
|
40mL
|
|
1バイアル中の有効成分
|
オキサリプラチン 50mg
|
オキサリプラチン 100mg
|
オキサリプラチン 200mg
|
|
添加物
|
濃グリセリン 50mg
|
濃グリセリン 100mg
|
濃グリセリン 200mg
|
|
性状
|
無色透明の液
|
||
|
pH |
4.0~7.0
|
||
|
浸透圧比
|
約0.23(生理食塩液に対する比)
|
||
|
対応する先発医薬品(一審原告製品)
|
エルプラット点滴静注液50mg(エルプラット50)
|
エルプラット点滴静注液100mg(エルプラット100)
|
エルプラット点滴静注液200mg(エルプラット200)
|
(4)争点
本事案における争点は、以下の4点です。
- 一審被告各製品が本件発明の技術的範囲に属するか否か(構成要件C,D,Gの充足性)(争点1)
- 延長登録された本件特許権の効力が一審被告各製品の生産等に及ぶか否か(争点2)
- 本件発明に係る特許が特許無効審判により無効にされるべきものと認められるか否か(新規性又は進歩性欠如)(争点3)
- 本件各延長登録は延長登録無効審判により無効にされるべきものと認められるか否か(争点4)
(5)延長登録された特許権の効力範囲についての裁判所の判断 (一般論)
裁判所は、延長登録された特許権の効力範囲の一般論として、存続期間が延長された特許権に係る特許発明の効力は、政令処分で定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」(医薬品)のみならず,これと医薬品として実質同一なものにも及ぶ、と述べました。一方、「均等の範囲」については、「法68条の2の延長登録された特許権の効力の範囲が広がり過ぎ,相当ではない」として、存続期間が延長された特許権に係る特許発明の効力には含まれないと述べました。
以下は、主として判決の抜粋であり、項目、下線、及び太字等は筆者によるものです。
存続期間が延長された特許権に係る特許発明の効力は,政令処分で定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」(医薬品)のみならず,これと医薬品として実質同一なものにも及ぶというべきであり,第三者はこれを予期すべきである・・・。したがって,政令処分で定められた上記構成中に対象製品と異なる部分が存する場合であっても,当該部分が僅かな差異又は全体的にみて形式的な差異にすぎないときは,対象製品は,医薬品として政令処分の対象となった物と実質同一なものに含まれ,存続期間が延長された特許権の効力の及ぶ範囲に属するものと解するのが相当である。(筆者注:ここでいう「成分」は有効成分に限られない。本事案での争点となった「濃グリセリン」は、添加剤である。)
そして,医薬品の成分を対象とする物の特許発明において,政令処分で定められた「成分」に関する差異,「分量」の数量的差異又は「用法,用量」の数量的差異のいずれか一つないし複数があり,他の差異が存在しない場合に限定してみれば,僅かな差異又は全体的にみて形式的な差異かどうかは,特許発明の内容(当該特許発明が,医薬品の有効成分のみを特徴とする発明であるのか,医薬品の有効成分の存在を前提として,その安定性ないし剤型等に関する発明であるのか,あるいは,その技術的特徴及び作用効果はどのような内容であるのかなどを含む。以下同じ。)に基づき,その内容との関連で,政令処分において定められた「成分,分量,用法,用量,効能及び効果」によって特定された「物」と対象製品との技術的特徴及び作用効果の同一性を比較検討して,当業者の技術常識を踏まえて判断すべきである。
[僅かな差異又は全体的にみて形式的な差異に当たる類型] (筆者注:本件発明は、類型②)
①医薬品の有効成分のみを特徴とする特許発明に関する延長登録された特許発明において,有効成分ではない「成分」に関して,対象製品が,政令処分申請時における周知・慣用技術に基づき,一部において異なる成分を付加,転換等しているような場合
②公知の有効成分に係る医薬品の安定性ないし剤型等に関する特許発明において,対象製品が政令処分申請時における周知・慣用技術に基づき,一部において異なる成分を付加,転換等しているような場合で,特許発明の内容に照らして,両者の間で,その技術的特徴及び作用効果の同一性があると認められるとき
③政令処分で特定された「分量」ないし「用法,用量」に関し,数量的に意味のない程度の差異しかない場合,
④政令処分で特定された「分量」は異なるけれども,「用法,用量」も併せてみれば,同一であると認められる場合
[均等の範囲についての裁判所の判断]
特許発明の技術的範囲における均等は,特許発明の技術的範囲の外延を画するものであり,法68条の2における,具体的な政令処分を前提として延長登録が認められた特許権の効力範囲における前記実質同一とは,その適用される状況が異なるものであるため,その第1要件ないし第3要件はこれをそのまま適用すると,法68条の2の延長登録された特許権の効力の範囲が広がり過ぎ,相当ではない。
ただし,一般的な禁反言(エストッペル)の考え方に基づけば,延長登録出願の手続において,延長登録された特許権の効力範囲から意識的に除外されたものに当たるなどの特段の事情がある場合には,法68条の2の実質同一が認められることはないと解される。
(6)本事案についての裁判所の判断(争点2)
本事案の「争点2」について、裁判所は以下のように述べました。以下の記載は判決の抜粋であり、下線及び太字等は筆者によるものです。
「延長登録された本件特許権の効力は,本件各処分の「成分,分量,用法,用量,効能及び効果」によって特定された「物」についての「当該特許発明の実施」の範囲で及ぶところ,本件各処分の「成分」は,文言解釈上,いずれもオキサリプラチンと注射用水のみを含み,それ以外の成分を含まないものである。これに対し,一審被告各製品の「成分」は,いずれもオキサリプラチンと注射用水以外に,添加物としてオキサリプラチンと等量の濃グリセリンを含むものであり・・・
本件各処分の対象となった物と一審被告各製品とは,少なくとも,その「成分」において文言解釈上異なるものというほかなく,この点の差異が,僅かな差異又は全体的にみて形式的な差異であるとして,法68条の2の実質同一といえるのか否かを判断すべきことになる。
本件明細書の記載によれば,オキサリプラティヌムは,種々の型の癌の治療に使用し得る公知の細胞増殖抑制性抗新生物薬であり,本件発明は,そのオキサリプラティヌムの凍結乾燥物と同等な化学的純度及び治療活性を示すオキサリプラティヌム水溶液を得ることを目的とする発明である(筆者注:上記類型②)。そして,本件明細書には,オキサリプラティヌム水溶液において,有効成分の濃度とpHを限定された範囲内に特定することと併せて,「酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤を含まないオキサリプラティヌム水溶液」を用いることにより,本件発明の目的を達成できることが記載されており,「この製剤は他の成分を含まず,原則として,約2%を超える不純物を含んではならない」との記載も認められる。これによれば,本件発明においては,オキサリプラティヌム水溶液において,有効成分の濃度とpHを限定された範囲内に特定することと併せて,何らの添加剤も含まないことも,その技術的特徴の一つであるものと認められる。
以上によれば,本件各処分と一審被告各製品とにおける「成分」に関する前記差異,すなわち,本件各処分の対象となった物がオキサリプラティヌムと注射用水のみからなる水溶液であるのに対し,一審被告各製品がこれにオキサリプラティヌムと等量の濃グリセリンを加えたものであるとの差異は,本件発明の上記の技術的特徴に照らし,僅かな差異であるとか,全体的にみて形式的な差異であるということはできず,したがって,一審被告各製品は,本件各処分の対象となった物と実質同一なものに含まれるということはできない。」
(7) 本事案についての裁判所の判断(争点1:構成要件Cについて)
本事案の「争点1」の構成要件C「オキサリプラティヌムの水溶液からなり」に関し、裁判所は、「オキサリプラティヌムと水のみからなる水溶液であるのか,オキサリプラティヌムと水からなる水溶液であれば足り,他の添加剤等の成分が含まれる場合も包含されるのかについて,特許請求の範囲の記載自体からは,いずれの解釈も可能である。」と指摘しつつ、本件明細書の記載及び出願経過を参酌して、構成要件Cの文言について「本件発明がオキサリプラティヌムと水のみからなる水溶液であって,他の添加剤等の成分を含まないことを意味するものと解さざるを得ない。」と認定しました。その上で裁判所は、一審被告製品は濃グリセリンを含有するので、本件発明の技術的範囲に属さないと結論付けました。
以下は、判決の抜粋であり、下線及び太字等は筆者によるものです。
「本件明細書には,「該水溶液が,酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤」を含有する場合に生じる不都合についての記載はなく,実施例においても,添加剤の有無についての具体的条件は示されておらず,これらの添加剤を入れた比較例についての記載もない。
しかしながら,前記出願経過において一審原告が提出した本件意見書には,本件発明の目的が,「オキサリプラティヌム水溶液を安定な製剤で得ること」及び「該製剤のpHが4.5~6であること」に加えて,「該水溶液が,酸性またはアルカリ性薬剤,緩衝剤もしくはその他の添加剤を含まない」点にあること,さらに,水溶液のpHが該溶液に固有のものであって,オキサリプラティヌムの水溶液の濃度にのみ依存すること,オキサリプラティヌムの性質上,本件発明の構成においてのみ,「安定な水溶液」を得られることがわざわざ明記されており、これらの記載を受けて,審査官が引用する引用文献1ないし3では,そのような「安定な水溶液」は得られないこと,すなわち,緩衝剤を含む凍結乾燥物やクエン酸を含む水溶液では,「オキサリプラティヌムの安定な水溶液」を得ることは(非常に)困難である旨が具体的に説明されている。その上で,本件意見書は,本件発明が法29条2項に該当しないとの結論を導いて審査官に再考を求めているのであり,一審原告はその結果として特許査定を受けているのである。」
3.医薬特許についての実務上の指針
今回の判決により、延長登録された特許権の効力範囲が、政令処分を受けた「物」と医薬品として実質同一なものには及ぶ一方、均等の範囲のものには及ばないことが明確になりました。ここで、対象医薬品が、政令処分を受けた「物」と異なる部分を有する場合には、その異なる部分が「僅かな差異又は全体的にみて形式的な差異」である場合に、「物」と実質同一であるとされます。この「僅かな差異又は全体的にみて形式的な差異」であるか否かについては、特許発明の内容に基づき判断されるとされています。本判決では、特許発明の4類型が示されましたが、それぞれの類型に基づき「実質同一」の範囲がどのように判断されるのか、未だ不明確な点も残されています。
医薬特許に係る延長登録出願の審査では、処分対象である医薬品類の製造販売が、延長登録の出願に係る特許発明の実施行為に該当するか否かが判断されます。また、延長登録後の特許権の効力の決定では、特許発明の類型が考慮されます。したがって、他の分野と比べて、特許発明のカテゴリーの決定や意見書等で述べる内容などについて、より一層の配慮が必要であると思われます。
(引用)
https://www.jpo.go.jp/shiryou/toushin/shingikai/pdf/new_shinsakijyun08_shiryou/10.pdf
「特許権の存続期間の延長登録出願に関する審査基準の点検・改訂について」
以上